前傳
最起碼你應該知道:
更新於 2019 年 12 月 25 日
※比較常見的 II-糖是胰臟能正常分泌胰島素或有不足,但組織對胰島素的敏感度下降或是阻力增加所致。I-糖則是一個完全不同的疾病型態,由於不明原因引發自體免疫系統攻擊分泌胰島素的 β-細胞,一旦胰臟產生的胰島素嚴重不足時,I-糖的症狀突然出現(註一)。
※在區域性或人種上,I-糖的發生率有極顯著的差異是個事實,但最近 30-40 年間各地區相關的流行病學研究均顯示 I-糖的發生率正快速成長中,有些地區甚至於每 20 年就倍增一次。這突顯出環境因素的重要性,理由是遺傳基因的特質在這麼短期間內不應該會有太大的變動,然而 I-糖的發生率卻不成比率地迅速竄升。
※以多種族的美國為例:在 2002~2018 年間 0~19 歲糖尿病的發生率,I-糖與 II-糖分別年增 2% 及 5%,但增加最多者為非白人種,而非西班牙裔的白人,甚至於只有少數增加 I-糖病例,II-糖更是少見。亞裔、太平洋島民、西班牙裔及黑人的 I-糖和 II-糖的發生率,分別年增 3~5% 及 7~9%,肥胖仍是這兩型糖尿病的共同風險。不論在鑑別診斷或治療的負擔上,這都是另一項趨勢的隱憂。(更新於 2023 年 07 月 22 日)
※儘管罹病原因不盡相同,任何年齡都可能罹患 I-糖,但出現臨床症狀(第三期)的 I-糖好發於兒童及青少年,約在 4~6 歲及 10~12 歲這兩個年齡層。全球 I-糖的發生率(新增病例數)年增 2~4 %,這種趨勢的變化不是線性而是指數性,且快速增加的族群落在小於 5 歲者。對於不明原因的兒童健康異常,建議當場加測血糖以排除罹患 I-糖的可能性。
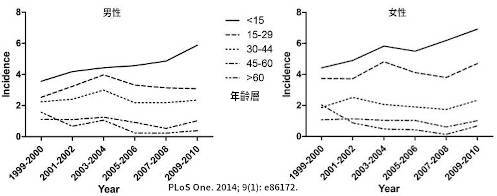
上圖:在台灣,統計 1999~2010 年間依性別、年齡層每 10 萬人中 I-糖的發生率。不論性別,發生率最高的年齡層落在 < 15 歲。
※依據 2019 IDF 糖尿病圖譜(Diabetes Atlas) 的報導:全球 20 歲以下的兒童及青少年,預估罹患 I-糖總人數已經超過 110 萬人。由於醫療的進步及壽命的延長,全球的盛行率(累積病例數)在最近 10 年內是倍增的,且在能預見的未來中也將持續增加,可以想見,I-糖病患在現代的醫療體系裡出現的頻率也會顯著地提升。在導入「第一型糖尿病指數(T1D index)」後,2022 年 IDF 糖尿病圖譜的報導顯示:不分年齡層,全球有 53 萬 I-糖的新增病例,其中 62%(32.9 萬)年齡 ≧ 20 歲。依據加入人工智能的推論後的 ver 3.0 T1D index,2025 年 IDF 第 11 版的糖尿病圖譜的報導顯示:預估全球不分年齡層罹患 I-糖的盛行率為 915 萬人,其中 181 萬人年齡小於 20 歲;預估全球不分年齡層的新增病例數為 50.3 萬人,其中 21.9 萬人 - 約 42% - 年齡小於 20 歲。各地區對於一名 10 歲時被診斷患有 I-糖的兒童其預期的平均剩餘壽命,則因政經狀況不同有相當大的差異,介於 6~66 年之間。(更新於 2025 年 08 月 08 日)
※通常罹患 I-糖被診斷出來時,至少 70% 以上的 β-細胞已經遭受「破壞」或「功能失調」(註二),此時此刻,體內分泌的胰島素已不足以維持正常血糖的恆定作用,血糖過高的所有症狀被一一暴露出來(諸如: 無來由的多渴、多食、多尿、體重減輕等等)。如果 β-細胞或功能保留越多(較常出現於發病在青年及成年期者),則疾病的緩解期(或稱為蜜月期)越長(註三)。
※與施打的胰島素無關,C-peptide 是檢測內生性胰島素的方法,它能反應疾病的現況,同時也是治療後是否有 β-細胞再生的生物指標。通常 I-糖患者其血清 C-peptide 的濃度都 < 0.2 nmol/L(< 200 pmol/L),若使用超靈敏度的檢測(可檢測極限值達 1.5 pmol/L),則發現罹病數十年後,仍有人能分泌微量的胰島素,且對高血糖也能做出反應,但分泌量隨罹病時間遞減。這些人治療所需的胰島素通常較少,嚴重的高血糖、低血糖或慢性的併發症也較少發生(註四)。檢驗室常見的單位換算:1 nmol/L = 1 pmol/ml = 1000 pmol/L = 3 ng/ml
※ I-糖是典型的遺傳基因、環境因素及近期受到普遍關注的免疫系統表觀遺傳特徵所促成的疾病,後者能藉由表觀遺傳的修飾及調節,與環境互動整合後有意義地改變遺傳基因的表現。事到如今,我們只知道這並非單一基因的變異,也無特定的環境因素可供參考。諸多曾被質疑的環境因素也都無法獲得實質性的驗證,有時結論更且相左,因此,每個人發病的具體事由也可能極不相同。
※同卵雙生罹患 I-糖的同病率(concordance rate)高於異卵雙生,但同卵雙生的同病率也未達 100%(不一致性接近 50%),這間接說明了除了遺傳因素外,仍有非遺傳的因素影響著罹患 I-糖的感受性。而成年發病者,其同病率遠低於兒童時期發病者,顯示不同發病年齡層間,其免疫病理的內因型(endotypes;或稱為「亞型」)明顯不同,發病年齡越小者,受遺傳影響的程度越多,同時胰島素分泌的能力也越少。
※ I-糖也不可能經過治療後升級成 II-糖,如你飲食毫無節制,且又遠離運動,那麼在不遠處迎接你的恐怕是肥胖症,還有一直虎視眈眈的『雙糖病(Double diabetes)』。
※從人類第一個接受胰島素治療(1922 年)至今也已近百年,胰島素一直都是治療 I-糖最有效的藥物,遺憾的是它並不聰明,時時都需要人為的調校,讓治療的過程倍感艱辛。在未有更理想的治療技術之前,具智能化的輔助性治療也是專家們投注的方向之一。
※由於 I-糖需要日以繼夜的照護,病患的年齡又小,有關治療的沈重負擔都落在父母親或親近的長者身上。
※大家有千百個理由想一探究竟,可惜臨床能簡易運用的知識相對有限,永遠有數不完的真相有待釐清。
※不過,與胰島素發現前的那個莫可奈何的年代相比,我們的心中充滿著感激。雖然無法雲破霧開,但明亮的桌燈下,仍有人埋首研究著更有希望的治療方式。
註一:基於個人化的治療目的及盡早發現可能的併發症的要求,新的分類將罹患糖尿病的成年人分成 5 個亞群(Clusters),譬如第二群者較容易併發視網膜病變,而第三群者較容易併發腎病變等等(Lancet Diabetes Endocrinol. online Mar. 1, 2018 ),但短期內糖尿病的治療趨勢也不會一夕之間改變。
註二:過去一直相信:I-糖確診時,90% 以上的 β-細胞已經遭受破壞,新近的研究指出:I-糖確診時,β-細胞遭受破壞的程度不一,實際為介於 50~95% 之間。
註三:現有的少數研究,分析 I-糖的胰島炎顯示:新發病的 I-糖病患體內,其胰島炎有兩種截然不同的型態,雖然 β-細胞遭受破壞的主要機制是由 CD8+ cytotoxic T-cell 所介導,但疾病惡化的速度及程度是由關鍵性的 CD20+ B-cell 浸潤的程度所決定,並指出發病年齡可能是一個重要的分水嶺。發病年齡 < 7 歲者,會出現典型的或猛爆型的胰島炎,具有 90% 以上「含胰島素的胰小島(insulin-containing islets;ICIs)」喪失的組織病理特徵,而發病年齡 ≧ 13 歲者,仍保留有 20~80% 不等的 ICIs,但其功能異常(有些學者認為有部份 β-細胞可能未遭破壞,而是呈現休眠狀態?)。發病年齡介於 7~13 歲者,則其 ICIs 的特徵可能是上述兩種型態之一(Diabetes 2016;65(5):1362–9)。這與過去的相關性研究有相當的一致性,這些研究顯示:罹病年齡越輕者,在診斷時及整個病程中均有較低的 C-peptide。
註四:能否檢出 C-peptide 與發病時的年齡、罹病時間、取樣型態及分析儀的靈敏度有關。一個小型的研究證實,大多數病患在罹病許多年後仍有微量(< 30 pmol/L)的 C-peptide 可以被檢測出來,且大多數仍能對進食做出反應。少數經過解剖的病例研究亦證實,在漫漫歲月之後,仍有極大比率的病患擁有一部分殘存的 β-細胞,這些細胞是否因為能躲過自體免疫的攻擊或於免疫反應改變後還能再生出來不得而知?而這些微量胰島素分泌的真正臨床意義也有待近一步釐清(Diabetologia 2014;57:187–191)。近期的大型研究更指出:C-peptide 的下降有兩個明顯分期,首先是診斷後 7 年內的快速指數性下跌期(半衰期約是 1 年),之後則呈現長期的穩定不變或緩慢的下跌狀態(半衰期估計是 15 年),C-peptide 的下降約在第 7 年出現轉折的臨床意義仍未明(Diabetes Care 2018;41:1486–1492)。所以即便罹病多年後,仍可在胰臟散在性的《一小撮胰小島》及《單一 β-細胞》內生成胰島素。
值得警惕的事:
1. 來自 UK Biobank 的資料研究顯示:發病於 30 歲之前與 31-60 歲間的比例分別是 58% 和 42%,但因為 I-糖僅佔所有糖尿病患 3-5% 左右,且發病於成年者大多為 II-糖,因此可能有許多年長的病例最初的診斷是錯誤的(Lancet Diabetes Endocrinol. Nov. 2017)。
2. 另一份來自中國大陸的 13 個地區,能代表 13 多億人口的最新資料顯示:於 2010-2013 整 4 年間,共新增 I-糖病患 5018 人,其中 2755(54.9%)為男性。以年齡區分:< 15 歲者增加 1239 人,介於 15-29 歲者增加 1799 人,≧ 30 歲者增加 1980 人。在新增病例中,年齡 ≧ 20 歲者的佔比高達 65.3%。雖然中國大陸與其它地區相比一直是 I-糖低發生率的國家,但與 20 年前 WHO DiaMond Project 的資料相比,I-糖的發生率仍激增了 3.8 倍,且高緯度地區有較高的發生率(BMJ Jan. 2018)。
3. 與 I-糖相關的全球性盛行率及發病率的研究資料相當稀少,根據分別來自 97 國及 37 國的 I-糖發生率和 I-糖死亡率的一項模型研究推估:2021 年,全球約有 840 萬人罹患 I-糖,其中 150 萬人(18%)年齡小於 20 歲,540 萬人(64%)年齡在 20~59 歲之間,160 萬人(19%)年齡在 60 歲或以上;當年則有 50 萬新確診病例(中位數發病年齡為 39 歲);大多數事件和流行病例均是成年人。預計到 2040 年時,流行病例將增加到 1350~1740 萬人(比 2021 年增加 60~107%)(Lancet Diabetes Endocrinol Oct. 2022)。
4. 近年來,接受『免疫檢查點抑制劑 (Immune checkpoint inhibitors;ICIs)』治療的癌症病人已經越來越多,當抗癌有成的掌聲猶不絕於耳,因治療而引起的「免疫相關的不良事件(immune-related adverse events;irAEs)」或所謂的「脫靶效應(off-target effects)」也同時浮出檯面,其中最嚴重者是併發『內分泌病變』。治療中出現了 I-糖的病例或許仍少見 - 估計約佔 1%,大多數是接受 PD-1 或 PD-L1 抑制劑治療的病患 - 約一半病例在未出現自體免疫抗體的情況下,呈現急性且其胰臟內的 β-細胞幾近被摧毀殆盡的「猛暴型 I-糖」。有些個案甚至於在接受治療的第一個星期內就猝發,但也有極少數個案是在接受完療程的數個月後才發病,這些都無法讓人心安(更新於 2022 年 04 月 11 日)。
望著圖發呆,彷彿一切都很簡單:
更新於 2021 年 02 月 01 日
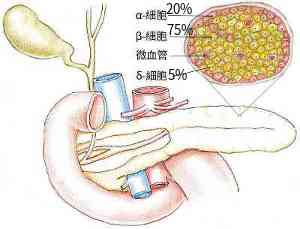
躲在胃部後頭的胰臟是個特化的精靈,它是一種混合腺體(heterocrine, or mixed gland),因為它擁有兼具外分泌和內分泌的功能。它的『外分泌腺』能提供消化酵素幫助食物的消化及吸收,而它的『內分泌腺』則是負責產生多種調節血糖的激素,是維持血糖恆定的定位浮標。人類的每一種『內分泌腺』在血液中都是一個具備化學感測器及正、負向回饋作用的精密閉路系統。
胰臟的這個閉路系統運作簡介如下:當進食後,血糖高升,胰臟感受了這個高位,胰島素分泌隨即增加,將血中的葡萄糖送往需要能量的組織器官,或是將血中的葡萄糖轉存入肌肉組織或肝臟內形成肝醣,以便不時之需。當飢餓時,胰島素分泌立即下降,同時昇糖素分泌增加,在門脈中,當胰島素與昇糖素比值下降時,就能促進肝臟將肝醣降解為葡萄糖,迅速釋放入血液中,以維持血糖的恆定。
擁有一個完整胰臟的情況下,這些機制即便你一丁點都不了解,它也能運作正常,但道理其實並不簡單,尤其是這個再自然不過的機制遭到破壞後更是如此,血糖的管理由一個原本精妙的自動系統被硬生生地調換成粗糙的手動系統,說能有多難就有多難。發展多年的自駕車不能順利上路的關鍵因素是無法排除人類的難以預測性,排除困難最簡單的方法是開闢自駕車專用道路或是所有的道路全用自駕車。目前治療血糖的機制也有類似的困擾,很多因素會影響血糖的代謝,諸如:成長、運動、壓力、生病、食物種類及心情等等,而且這些因素所影響的程度很難以評估。在未使用新的治療技術 - 包括新的類胰島素、胰島素幫浦、連續血糖監測或更先進的人工胰臟等等 - 之前,為了降低干擾,你有必要採取規律的生活,連進食份量、進食時間及運動方式也都得固定下來,如此或多或少能鋪出一條屬於你自己的專用治療渠道。
在下筆的此刻,不論你使用何種方式治療,也不論你使用的『幫浦』或『連續血糖監測』有多麼精細(它們總有出錯的時候),它都不是一個能替代胰臟的魔法師。就算你採取了看似毫無懸念的策略,胰島素通常不是給的太多,就是給的太少。這不是你的錯,因為現有的治療技術無法讓人心滿意足罷了。
為了預防長期血糖異常所導致的併發症 - 這些併發症一旦產生,大多是不可逆的嚴重疾病,因此即便是困難重重,專家們一致渴望:除非是治療所需的資源不足、無法感受或表達低血糖的症狀者外,不分年齡最起碼要將 HbA1c(或簡稱:A1C) 的目標值設定為 < 7.0%(依據 ADA's 2020 Standards of Medical Care),前提是必須要沒有嚴重低血糖或經常性低、中度低血糖的疑慮,簡單來說,你必須謹記低血糖所造成的傷害大多是立即性、且可能相當嚴重的,而一般高血糖所帶來的傷害還在稍遠的未來。但與過去相比,因嚴格治療後容易導致低血糖的困擾早已被臨床可用的工具逐一瓦解,低血糖的疑慮不應再橫亙於前,成為阻礙目標達成的屏障。
經過多年來的治療技術進步後,所有具備樣本廣泛、有臨床實證基礎、且觀察期間夠長的前瞻性研究都指出 A1C 是目前唯一可靠的預肪長期併發症的治療指標。請不要逃避 A1C 給你的治療評價,當你的 A1C > 7.0% 時,請在你的 logbook 上高高地豎起紅色的警戒旗標。(請參考『慢性併發症』章節)
避免曲解 A1C 的目標值:
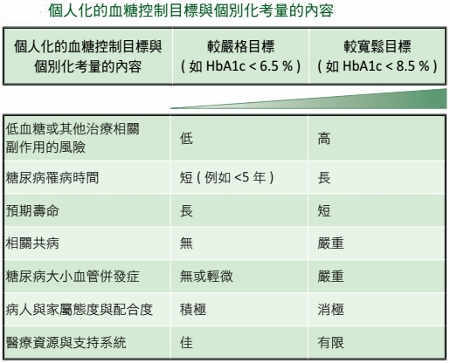
1. 所有學會的共識:A1C 的目標值越趨近理想值,其併發症越少。在沒有無警覺性低血糖、嚴重或經常性低血糖的疑慮,以及其它共病症等安全因素需要考慮,且無須增加其它治療負擔及減損生活品質而容易達成目標的話,則 A1C 的目標值設為 < 7.0%(ISPAD),甚或 < 6.5%(NICE)並無不妥(ISPAD Clinical Practice Consensus Guidelines 2018)。反過來說,針對特殊的個案,則 A1C 的目標值設為 < 7.5%,甚或 < 8.0% 也不為過(ADA's 2020 Standards of Medical Care)。

上表:不同協會之間的血糖管理建議(註:ADA 已於 2020 年起將 A1C 的目標值重設為 < 7.0%)
2. I-糖是一個橫跨數十年的慢性疾病,發病初期因為沒有其它的併發症需要考慮,將 A1C 的目標值設定在較為嚴格的範圍內尚屬合理。但 A1C 的目標值並非一成不變,隨著歲月的經過,應適時地評估現狀來調整。
3. 孕婦除外的大多數成年人,因為其代謝已經趨於穩定,應將 A1C 的目標值設定為 < 7.0%;飯前血糖 80-130 mg/dl;飯後血糖 < 180 mg/dl(Glycemic Targets: ADA Standards of Medical Care in Diabetes - 2020)。
上表:2018 年(更新版)糖尿病臨床照護指引
