卡介苗(BCG)真的能成為治療的新希望?
一個值得緊盯的研究
更新於 2021 年 02 月 01 日
由美國麻州總醫院(MGH)的 Denise Faustman 醫師所領導:『施打卡介苗(Bacillus Calmette-Guérin vaccine;BCG)以治療 I-糖』的研究引起了全球性的關注(npj Vaccines 2018;3:23)。起心動念的背後:Faustman 醫師是一位嚴謹、執著、不盲從的學者。在此之前,她參與胰島細胞及腎臟合併移植的工作已經多年,伴隨著抗排斥藥物的使用腎臟移植雖然成功,但胰島細胞移植部份始終都以失敗告終。多年潛研後,她確認失敗的主因是攻擊胰島細胞的免疫系統不僅僅是在診斷時發生(這是上世紀 8、90 年代一般性的見解),而是它在之後也一直都未消失。停止移植工作後,她選擇施打卡介苗(BCG)可以促進調解性的 T-細胞(它們有能力消滅導致 I-糖的壞的 T 細胞)的特性加以研究,才有這次的實驗。
化石的佐證下,人類與肺結核菌已共同演化長達 9 萬年以上(註),而減毒性的卡介苗使用至今剛滿百年,是人類使用的最古早疫苗之一。依據「衛生假說(hygiene hypothesis)」:工業化後,文明往都市集中,消毒劑、清潔劑、抗生素大量使用,又有多種疫苗的協助,加上與家畜及土讓的接觸減少,使個體缺乏接觸共生微生物或其它傳染源,因此抑制了免疫系統的健全發展,增進了罹患過敏性疾病及自體免疫性疾病的可能性。基於這些理念,免疫學家希望藉由 BCG 的誘導,讓個體的免疫系統能經由表觀遺傳及代謝重編程的作用得到再教育以改善體質,這種作用稱為「訓練免疫(trained immunity)」,以別於「先天免疫」或「後天免疫」。訓練免疫並無致病菌的專一性,它能賦予更寬廣的保護作用。之前,除了預防肺結核外,卡介苗已經被使用於治療「早期的膀胱癌」及「多發性硬化症」的病人身上,專家對於卡介苗所引起的相關免疫代謝的改變並不全然陌生(Front. Immunol. Apr. 21, 2016)。
在第一期的臨床實驗看似失敗後,意外地在同一組人延長的臨床實驗中(前後為期 8 年)獲得一些令人鼓舞的成果。緊接著第 2 期臨床實驗於 2018 年啟動,預計於 2023 年完成(註:許多研究計畫,都因為沒有顯著的療效或其它嚴重的副作用等因素,於第 2 期臨床實驗中被迫劃下休止符)。
在初期的動物實驗中,注射 BCG 能使自體免疫性 NOD 老鼠的 β-細胞再生的現象在人類身上並未發生(或只是少量、短暫地出現)。最後,總結此 8 年的實驗成果如下:罹病至少 2 年(許多已達 15 年以上)的成年人、使用已過專利年限的 BCG(選擇 Connaught 菌株,耗費少且方便取得)、至少需要肌內注射 2 劑 BCG(兩劑相隔 4 週)、療效出現前會有 3-4 年的延遲(這可能是完整的體內表觀遺傳重編程所需要的時間,以 BCG 治療『多發性硬化症』也有相似的時間延遲現象)、不需追打的情況下降低高血糖的療效(使 HbA1c 接近正常值)至少能維持到第 8 年、仍需要注射胰島素(作者聲稱實際用量有減少約 1/3)、低血糖的事件沒有增加,且未出現嚴重低血糖及明顯的副作用。
從自體免疫疾病的研究中,我們知道,患者體內的免疫環境是能抑制發炎反應的「調解性 T-細胞(regulatory T cells;Tregs)」太少,而具破壞力的「細胞毒性 T-細胞(cytotoxic T cells;CTLs)」又太多。過去認為,治療自體免疫疾病需要的是「免疫抑制劑」,而非「免疫促進劑」,使用免疫抑制劑雖能達到部份治療目標,但缺點是對健康的細胞也有傷害,因而讓治療一直裹足不前。最近 1、2 十年,注射 BCG 當促進劑,刺激體內免疫系統的再平衡及重塑免疫的耐受力以治療自體免疫性疾病的一連串實驗,揭開了新的治療序幕。
註:基於現代分子遺傳學和基因組定序的技術,可以更嚴格地估計分枝桿菌的起源時間,現代結核分枝桿菌的所有譜系似乎起源於大約 1.5~2 萬年前的共同祖先。以結核分枝桿菌已知突變率來分析,這些菌株目前的多樣性大部分起源於 250~1000 年前。
注射 BCG 疫苗後,體內產生了什麼變化:
1. 在人體的免疫系統方面:BCG 可使體內「腫瘤壞死因子(tumor necrosis factor;TNF)」 增加,從而誘導及修復了「調解性 T-細胞(Tregs)」的過度甲基化(over-methylation),並正向調控其功能以阻止自體免疫攻擊的效應;在此同時藉由選擇性地消除促使 I-糖發病的致病性「自體反應性 T-細胞(autoreactive T cells)」,以降低此發炎反應。
2. 在人體的免疫代謝方面:經由高通量的代謝體學分析(metabolomic analysis)、轉錄體定序(mRNA sequencing)和功能性細胞葡萄糖攝取鑑定(functional assays of cellular glucose uptake)等綜合研究得知,人體在注射 BCG 後,透過『表觀遺傳重編程(epigenetic reprogramming)』的機制,修飾了原有基因該有的表現,使得免疫細胞內的血糖代謝路徑,系統性地轉移 - 將 I-糖的免疫細胞內原本偏好的高效能低耗糖的『氧化磷酸化(oxidative phosphorylation;oxidative glycolysis;OXPHOS)』代謝路徑,漸進性地轉換成(或止於)低效能高耗糖的『早期的需氧醣解(early stage of aerobic glycolysis)』代謝路徑。透過酵素分析知道:在細胞的代謝路徑中,基因的表現正向調控了「早期的需氧醣解」,且負向調控了「氧化磷酸化」。此外,早期的需氧醣解作用也會產生更多的生合成先驅物質(biosynthetic precursors),從而增進細胞內生合成的能力。
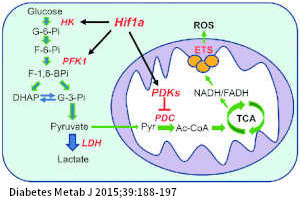
註:如左圖,在細胞的能量代謝中,不論是「左:早期的需氧醣解」或是「右:氧化磷酸化」將葡萄糖轉變成「丙酮酸(pyruvate)」的過程均在細胞質中進行。緊接著,前者在細胞質內續將丙酮酸代謝成乳酸(lactate),效能較低,但速度較快,1 個葡萄糖只產生 2 個 ATP,產生足夠的能量需消耗較多的葡萄糖,換句話說,提升了葡萄糖的利用率;後者則在粒線體內將丙酮酸轉變成「乙醯輔酶-A(Acetyl-CoA)」,再經由「克氏循環(TCA cycle)」及「電子傳遞鏈(ETS)」進一步氧化代謝,多生產了 2+34 個 ATP,速度較慢,但產生相同熱量只需消耗相對少量的葡萄糖。
3. 在表觀遺傳重編程的作用下,需氧醣解成為免疫系統能量代謝的主要路徑,同時也激活了「五碳糖磷酸路徑(Pentose Phosphate Pathway;PPP)」及強化葡萄糖在細胞膜的轉運作用,後者可能與促進胰島素的敏感性有關。(註:PPP 從「葡萄糖 6-磷酸 (glucose 6-phosphate;G6P)」 分支出來,也稱為「五碳糖磷酸分流(Pentose Phosphate shunt)」,是維持細胞還原氧化 (redox) 恆定和生合成的主要調節機制,在此將非六碳醣分流回糖酵解)。
4. 加總上述三個代謝的改變,在不額外依賴胰島素的協助下,免疫系統能依血糖高低調節性地加速血糖轉運入細胞內,當血糖高時適時地啟動高耗糖的「早期的需氧醣解」作用,以達長期降低血糖至近乎正常水平的效果(使 HbA1c 平均降至接近 6.5%),且未出現嚴重低血糖,讓免疫系統的需氧醣解作用提供一個額外的血糖調控器。
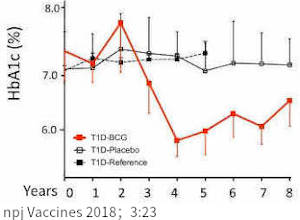
上圖:白色為使用安慰劑的對照組、黑色為未參與本實驗的參考組、紅色為接受 BCG 注射的實驗組。接受 BCG 注射者,其 A1C 自第 3 年起有 > 10% 的進步
首先,需要 3 年以上的磨合醞釀期才出現預期療效的實驗結果讓人印象深刻,我們首次感受到「表觀遺傳」潛移默化的功力,在初期不顯眼的改變之後,隨著時間的積累滴水穿石,其威力才會正向(或負向)性地顯現出來,生活中好、壞習慣對身體的影響應該也是如此。
雖未能恢復胰小島內 β-細胞的功能,但這個創新的代謝高血糖的治療模式幾近創造一個『人為的蜜月期』。在只激活特定基因而不改變基因序列的前提下,以表觀遺傳重編程的作用來調節基因的表現,就能達到長期降低血糖的目標,確實吸引了眾人的目光,如果一切順利又夠安全的話(包括為期 5 年的第三期臨床實驗也完成,獲准使用至少還得等到 2028 年),無疑地它註定將在糖尿病的治療史上寫下新篇章,而目前我們為了相似效果所使用的諸多工具也都將變得微不足道。
但這究竟是個臨床醫學上比較陌生的治療方法,在我們期待能釐清的部份還未能獲得正確解答之前,都只能算是「非常鼓舞人心」而已,問題應該包括:對於已經普遍施打過卡介苗的地區,這個方法仍適用嗎?何種菌株最理想?劑量為何、施打的間隔為何、何時追加及追加幾劑才能起到最佳化的作用?是否任何年齡層均適用?也能當成高危險群的預防性治療措施嗎? - 這些疑問僅只是我們滿腦子狐疑的一部分而已。
註一:卡介苗是一種牛的分枝桿菌所製成的活性減毒疫苗,台灣自 1979 年起採用 Tokyo 172 菌株的卡介苗,已知 Tokyo 172 與 Connaught 菌株之間細胞壁的脂質成份不同,施打後所造成的人體反應也不相同,前者的「毒性或致病性」及「反應原性」較低。
註二:目前已知單劑的卡介苗無法啟動適度的表觀遺傳重編程及有效地改變免疫細胞的代謝作用,同樣在膀胱癌的卡介苗腔內灌注治療中,亦觀察到使用單劑或次數不足時也起不到治療的作用。近期在希臘一項研究顯示:非強制性地給 9 歲兒童施打一劑卡介苗的結果,可以延遲 I-糖發病 2.5 年(Diabetes Ther. 2021;12:2971–2976)。
註三:在希臘有一項名為 ACTIVATE-2 的研究:主旨是評估 BCG 疫苗對 2019 年冠狀病毒病的療效。這項多中心、雙盲試驗,有 301 名 50 歲或以上的志願者參加,併隨機(1:1)接種卡介苗或安慰劑;實驗的觀察指標是 COVID-19 的發病率和抗嚴重急性呼吸綜合徵冠狀病毒 2(抗 SARS-CoV-2)抗體的存在,這兩項均在研究干預後 6 個月內進行了評估。結果顯示,接種卡介苗患有 COVID-19 的風險相對降低了 68% (OR 0.32, 95% CI 0.13-0.79),BCG 疫苗接種可以在 50 歲以上患有合併症的患者中對可能的 COVID-19 提供一定的保護。(Front Immunol. 2022 Jul 5;13:873067)
註四:新近兩個觀察性的研究亦顯示卡介苗對 I-糖的療效。(一)分析了三個大型美國患者數據庫:篩選 I-糖或 II-糖患者,同時又有膀胱癌,併接受 BCG 治療,然後通過回顧性評估 BCG 隨後逐年對血糖趨勢的影響,結果:多劑量 BCG 治療與 I-糖中 A1C 的多年穩定降低相關,但與 II-糖無關(註:這有一種可能是美國的 II-糖病患大多服用二甲雙胍(metformin),而二甲雙胍會干擾這種 BCG 控制的代謝途徑)。(二)對全球數據進行了生態分析,以評估新生兒強制性卡介苗接種與 I-糖和 II-糖發病率之間的國別關聯性,在兩個國際數據庫中,實施強制性新生兒卡介苗接種政策的國家其 I-糖的發病率較低,在其中一個數據庫中 II-糖的發病率較低。(PLoS One 2023 Jan.20;18(1))
註五:研究得知,即便氧氣充足、粒線體的功能也正常,癌細胞、分裂及發展中的細胞也偏向使用需氧醣解的代謝路徑以獲得能量,這種由正常細胞使用的氧化磷酸化的能量代謝路徑轉向早期的需氧醣解代謝路徑的現象,就稱作『瓦氏效應(Warburg effect)』,其實質的意義至今仍無定論。
MGH 研究團隊的後續報導
更新於 2021 年 12 月 04 日
MGH 在 2021 年 6 月 25 日發表新聞稿:在收集了 143 位已經接受過 2 劑 BCG 治療的案例後 - 包含 25 例兒童期發病的成人,該研究團隊將正在進行中為期 5 年的第二期雙盲隨機實驗(預計收錄 150 人、完成研究還需時 2 年)的研究資料更新,Denise Faustman 醫師說:「我們有持續的證據顯示 BCG 能重設及復原(病人的)免疫系統」,並在 ADA 第 81 屆科學會議的簡報中強調 BCG 治療的安全性及降低血糖的能力。研究成果的新亮點如下:
1. 相比於成年發病者,21 歲前發病的 I-糖對於 BCG 治療的反應較快,且 HbA1c 的降幅更大。
2. BCG 治療 3 年後,病患針對 Tregs 基因 Foxp3 的無過度甲基化已與一般健康人無異。
3. 青少年期發病者,在 BCG 治療 2 年後 HbA1c 下降的反應程度已經達到本實驗第一期成年受試者 3 年後能企及的水平。
該屆會議後給的回應:正如 GlobalData 採訪的主要意見領袖 (key opinion leaders;KOLs) 所確定的那樣,由於缺乏緩解疾病的療法(disease-modifying therapy)是 I-糖治療中一個關鍵性的未滿足需求,因此在一樣無法否定對外源性胰島素的需求的情況下,BCG 作為一種重新定位的治療藥物,於競爭中正處於有利地位,可以勝過其它已經在籌劃中更昂貴的免疫療法的選項,以解決這種醫療的迫切需求。同時指出,兩劑 BCG 對於已經罹病多年的 I-糖有效,後續的研究剛好可以補足證明新近發病者是否也有效。
在 2018 年 - 第一期的實驗還未補足延長試驗後令人動容的成果,同一團隊在該年年會的簡報中所呈現的結果獲得「仍有爭議」的差評。本屆大會給予該團隊的正面回應剛好彌補了一直以來為它所流失的大量汗水。加油!Faustman 醫師們!
註:針對兒童的實驗,名為「重複接種 BCG 疫苗以治療小兒 1 型糖尿病(Repeat BCG Vaccinations For The Treatment Of Pediatric Type 1 Diabetes)」。該研究涵蓋多家醫學中心,將招募 150 名 12~17 歲的患者進行有安慰劑對照的研究,預計注射兩劑 BCG,間隔 4 週。實際研究開始日: 2022 年 3 月 22 日;預計研究完成日:2027 年 3 月。
BCG 疫苗的脫靶效應(off-target effects)
更新於 2024 年 06 月 30 日
引言:2020 年的冬天一開始,第二波 COVID-19 不可思議地重創了美歐等唱作俱佳的大國,除了政策、氣候及民情等個別因素外,大家也注意到,在醫療進步的地區,其防疫成效似乎落後於開發中國家。研究疫苗的專家苦思後指出,這個差異很可能是來自該地區普遍接受注射卡介苗的『脫靶效應』,是疫苗在體內所產生的非特異性作用。卡介苗不僅能預防嬰幼兒感染肺結核病,同時也能降低嬰幼兒全因性死亡率,也就是說卡介苗還能預防與結核病無關的感染,如流感、敗血症或皰疹等等。卡介苗所啟動的訓練免疫有可能讓很多人不只減少感染新冠肺炎,即便感染了,病情也較輕,可惜未能獲得證實。當然施打其它減毒性的活菌疫苗也可能有類似的效應,卡介苗特別被關注是因為那些結核病低盛行的地區不打卡介苗已經很久了。
隨著新冠病毒大流行的擴展,許多國際性的研究試圖給成年人 BCG 疫苗單次注射或給先前已接種過 BCG 疫苗者再一劑加強針注射,測試是否可以預防 COVID-19 的感染,這些研究數據擴大了全球大型臨床試驗資料庫,並顯示給新生兒注射卡介苗可以作為所有傳染病的預防平台,且療效可能持續數十年。在最近的 8 項臨床試驗的事後分析中,接受 BCG 疫苗者比對照組有更低的死亡率,可惜針對先前接種過 BCG 疫苗者所進行的加強劑試驗其結果好壞參半,其中 5 項隨機試驗顯示有療效,7 項隨機試驗顯示沒有任何益處,造成這些研究上的失敗結果有很大原因是設計不良所導致,不是追蹤時間不足或僅只一次劑量,就是先前已打過疫苗或已感染過肺結核。Denise Faustman 醫師指出:「參與者先前在新生兒時接受過卡介苗疫苗或之前接觸過結核病的國家進行的試驗可能掩蓋了【卡介苗加強劑】的任何益處。」,另一方面,由過去的研究資料顯示:對於未接種過 BCG 疫苗或感染過肺結核的人來說,接種 BCG 疫苗後的脫靶效應可能需要至少兩年才能實現,且給予多劑疫苗可能會加速這一效應。
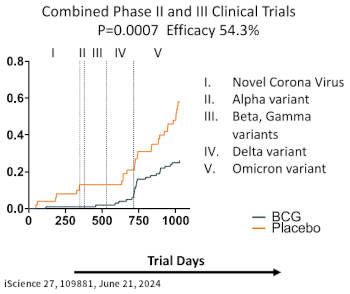
MGH 測試 BCG 疫苗的 II 期和 III 期 - 雙盲、隨機對照(RCT) - 臨床試驗(題目:Multiple BCG vaccinations for the prevention of COVID-19 and other infectious diseases in type 1 diabetes)與其它 BCG 疫苗試驗在設計上有所不同:在美國沒有實施新生兒卡介苗預防接種,且非肺結核病流行地區,在這樣的基礎下,先前沒有接受過任何一劑 BCG 疫苗或感染過肺結核的參與者,在本實驗中接受了 5~6 劑特別有效的 BCG 疫苗,同時所有參與者,未曾中途脫隊,總共被追蹤了 36 個月,而不是幾週或幾個月而已。兩期實驗的簡介如下:
a. II 期和 III 期是連續的實驗,均使用 Tokyo 174 BCG 菌株。所有參預者在各期監測受感染開始之前的 2 年期間內,至少打過 3 劑。
b. II 期實驗在大流行的初期進行(2020 年 1 月至 2021 年 4 月、為期 15 個月),此時期病毒的致命性高但傳播性較低,診斷全賴專一性的抗體的型態分析,BCG 疫苗的功效為 92%,與當時的 BNT 或 Moderna COVID-19 疫苗在健康成人中的療效相當。結果發表於《Cell reports Medicine,2022》雜誌。
c. III 期實驗在大流行的後期進行(2021 年 4 月至 2022 年 11 月、為期 19 個月),此時期 COVID-19 的變異株盛行(系列變異株為 Beta, Gamma, Delta, Omicron),與前期相比,這些病毒的傳播性較高,但有些變異株的毒性則較低,診斷轉為依賴定點照護檢測(point-of-care testing;POCT),BCG 疫苗的功效為 43.2%,看似少於前期的效力,但仍明顯有效。同時期更多的抗 COVID-19 疫苗被開發出來,主要是 mRNA 疫苗,也如其它的報告所顯示:針對 I-糖病患,單獨使用 mRNA COVID-19 疫苗無法起到任何保護作用,但兩者之間也互不干擾。結果發表於《iScience,2024》雜誌。
總結:在美國 COVID-19 大流行的整個 34 個月中,BCG 疫苗的預防療效平均達到 54.3%,可以說是相當顯著。研究還發現,除 COVID-19 外,接受 BCG 疫苗治療的參與者對其它病毒、細菌和真菌感染的發生率也較低。
上述實驗的重要性在於:
1. 糖尿病患極易感染傳染病,並且在感染 SARS-CoV-2 病毒時結果會更糟。不論是 I-糖或 II-糖病患,感染 COVID-19 後的致死率是其它族群的 2 倍。
2. 就已公佈的研究數據顯示:各種目前已知的商用 mRNA COVID-19 疫苗對易受感染的 I-糖病患都不是很有效。就說是無益也無害吧,打完 COVID-19 疫苗後也很容易被突破。
3. BCG 疫苗的加強劑特徵:再接種 BCG 疫苗加強劑後的脫靶效應具有遲滯的特質,可能需要至少兩年才能實現(觀察時間不足是造成研究結果混淆的主要原因),但給予多劑疫苗可能會加速或增強這一效應。
註:研究顯示:在嬰兒時期接種過一劑卡介苗者(如台灣地區),對 I-糖的發生沒有保護或促進作用(Pathogens. 2023 Apr 12;12(4):581)。因此對這些病例來說,BCG 疫苗單劑無療效並不意味著使用加強劑也毫無療效(還需要更多研究分析)。
卡介苗可以預防傳染病,這是共同主要結果:
在連續兩期內,分析 MedDRA 分類編碼收集到的傳染病不良事件,包括病毒、細菌和真菌感染及 COVID-19 疾病本身,BCG 疫苗均提供了對各類傳染病的廣泛保護。
研究顯示 mRNA 疫苗在 I-糖病患受試者中不會引起任何 T 細胞反應,因此 I-糖病患受試者不具備利用適應性免疫反應的 T 細胞以啟動適當免疫反應的能力,所以施打 mRNA COVID-19 疫苗並未能產生預期的效果。
I-糖是一種 T 細胞驅動的自體免疫疾病,T 細胞受體 (T cell receptor;TCR) 訊號傳導影響著 CD4+和 CD8+ T 細胞免疫生物學的多個面向。數據顯示 I-糖病患通常具有 T 細胞受體複合物(TCR complexes)表現低下的特徵,這是由於 TCR 及 TCR 複合物相關 CD3 蛋白的基因《過度甲基化》所致。而 BCG 疫苗對 COVID-19 和其它傳染病的益處可能源於它透過許多關鍵性 T 細胞受體基因的《去甲基化》來增強它原本失去的 T 細胞反應。施打 BCG 疫苗後,透過『表觀遺傳重編程』的機制來修正這項過度甲基化的基因表現,需時 3 年的過程,這時程也正是它的脫靶效應出現之所在。(註:透過多劑量 BCG 疫苗治療後的觀察顯示:超過 23,000 個基因在第 1 年時間點發生去甲基化,前 200 個甲基化程度最高的基因中有 90 個與 TCR 相關,而這個過程持續了 3 年之久。---SCI. ADV. 16 Nov. 2022 Vol 8, Issue 46)
在尋找替代方案成為當務之急時,很明顯地,mRNA COVID-19 疫苗針對的是範圍較狹窄的病毒株,需經常修飾疫苗以應付不同的變種病毒株,且這些疫苗的抗體效力常在 3~6 個月後顯著地降低。BCG 疫苗與此不同,它能產生比對抗 COVID-19 不同變異株外更廣泛的其它感染原的預防效力,更甚者,如前述它還有益於血糖的代謝,且兩種效力均能持續長達數十年之久。
BCG 治療晚期第 1 型糖尿病的臨床試驗計畫-2025 年最新進展 |全文引用 --- 糖尿病 2025;74(增刊_1):881-P
更新於 2025 年 11 月 29 日
引言與目的: 卡介苗(BCG)疫苗最初於 100 多年前研發,用於預防結核病感染。目前,針對該疫苗的隨機 I-III 期人體臨床試驗表明,BCG 可能對人類免疫性疾病(如第 1 型糖尿病(T1D))和某些傳染病具有保護作用。 BCG 調節 T1D 患者血糖控制的能力涉及多種免疫和代謝機制,包括糾正白血球中潛在的有氧糖解缺陷以及逐步誘導調節性 T 細胞以抑制自體免疫反應。本文將介紹本院 BCG 計畫的最新進展。
方法: 超過 600 名早發型 1 型糖尿病(21 歲以上)患者已入組臨床試驗方案,以測試卡介苗降低糖化血紅蛋白(HbA1c)、減少胰島素需求和穩定血糖的能力;其中 364 名患者接受了治療。另一項針對第一型糖尿病患者的研究評估了卡介苗預防感染的能力。目前的兒科研究採用 2 劑卡介苗;成人試驗採用 6 劑。
結果: 一項已完成的隨機、安慰劑對照的 I 期臨床試驗對患有長期早發型 1 型糖尿病(無胰腺 C 肽)的成年患者進行了長期隨訪,結果顯示,多次卡介苗治療後,糖化血紅蛋白(HbA1c)值可降低 8 年以上。在兩項針對早發型 1 型糖尿病成年患者的開放標籤臨床試驗中,多次卡介苗治療後觀察到 HbA1c 降低 10-15%。一項針對患有長期早發型或晚型 1 型糖尿病的成年患者(n=150)的隨機、雙盲、安慰劑對照的 II 期臨床試驗已對所有患者進行了 5 年的隨訪;結果待公佈。目前正在進行 II 期、雙盲、隨機、安慰劑對照的兒科臨床試驗,以評估卡介苗對長期和新發 1 型糖尿病的療效。
結論: 卡介苗可透過改變淋巴球內的葡萄糖代謝來發揮作用,且此作用獨立於胰腺,即使在第一型糖尿病發病數十年後仍有效。兒科試驗的優點在於發病年齡較早,且部分病例仍保留胰臟功能。卡介苗療法可能為長期第 1 型糖尿病患者提供安全且經濟的治療手段。
