早期預防
千金難買早知道:
更新於 2023 年 07 月 01 日
撇開尷尬的人類宿命,不論什麼時代,疾病的預防一直都是非常重要的課題,I-糖自不例外。但如果你尋找有關 I-糖長期有效的預防措施為何?那麼你得到的回答可能與「無可奉告」差別不大。為什麼歷經數十載孜孜矻矻的研究,而結論總是那麼讓人遺憾,這有一大部分要歸因於我們對 I-糖的促發因素 - 包括遺傳、環境及免疫 - 所知有限的緣故;另一方面,現有對於「單一因素」的研究方式也不利於探討 I-糖這種極其複雜的「異質性的疾病(heterogeneous disease)」。
雖然 HLA class II 等位基因的研究告訴我們,即便在斯堪地那維亞半島這一區域,有高達 90% 以上的 I-糖罹病者具有 HLA-DR3、DR3-DQ2 或 HLA-DR4、DR4-DQ8 的單倍體基因特性,另有 30% 則同時具有這兩種單倍體,稱為 DR3/4 雜合子(heterozygotes),但 85%~90% 的新發患者並沒有 I-糖的家族史,因此《預防性篩查》勢必要涵蓋數量龐大的普通人群,讓預防性的干預策略變得昂貴且具挑戰性。
在誘導 I-糖發病的不同反應途徑上(註),其作用最終都是導致 β-細胞遭受破壞,很顯然我們還無法將所有路徑一一釐清。目前最高的醫療目標應該會放在《高危險群》的篩檢及預防性治療上,以期保留最多可用的 β-細胞,但疾病的成因包含遺傳基因、感染、飲食及體液等多面向的交相作用,綜上所述,使得《高危預測》、《高危篩查》及《早期預防性治療》這一點點心願都是奢求。
註:在「全基因的假說(omnigenic hypothesis)」中:提出細胞內表達的所有基因都會影響特定性狀的表現。簡單地說,複雜性狀的遺傳性是由直接影響性狀表達的核心基因(core genes)和那些不直接影響性狀表達的周邊基因(peripheral genes)所呈現。核心基因可能對性狀遺傳力(trait heritability)產生顯著及可檢測的影響,因此直覺上,我們會認為核心基因的致病變異就聚集在驅動疾病病因的關鍵路徑中。然而,核心基因解釋的遺傳力卻遠低於週邊基因,由於週邊基因的個別效應雖微小 - 且這些微小的關聯訊號往往分佈在許多與疾病沒有明顯關聯的基因附近,但其數量卻遠遠超過核心基因的數量,因此核心基因解釋的遺傳力被眾多的週邊基因所稀釋。該模型顯然已經超越了多基因(polygenes)模型的範疇(更新於 2026 年 01 月 30 日)。
由於目前仍缺乏有效的預防性治療,加上篩檢的結果可能留下恐慌,因此預防性篩查在現階段仍屬於研究探討而已。
醫療擬定的預防策略:
初級預防:目標是年幼的罹病高危險群,預防引發對抗胰小島自體抗原的自體免疫反應發生。
次級預防:目標是已經產生至少 2 種自體抗體,不論 β-細胞有無功能失調,設法阻止該自體免疫反應演進成有症狀的疾病。
三級預防:呈現症狀性疾病後,把焦點放在延長蜜月期(延長 β-細胞功能)、減少疾病的併發症。
現有少數預防性治療的實驗:
1. 一項針對確診百天內為 I-糖病患的第 2 期試驗中顯示:靜脈注射低劑量的『抗胸腺細胞球蛋白(anti-thymocyte globulin:ATG)』連續 2 天,分別為 0.5 mg/kg 與 2 mg/kg (共 2.5 mg/kg),與對照組相比,在至少 2 年內,其 C-peptide 的 AUC 顯著地增加,且 HbA1c 明顯地降低,同時以「流式細胞術(Flow Cytometry)」的分析亦證實 CD4(T helper):CD8(T cytotoxic) 的比值降低,且 Treg:Tconv 的比值增加,注射低劑量的 ATG 改變了免疫細胞的組成,並提昇了免疫的耐受性(Diabetes 2019 Jun; 68(6): 1267-1276)。低劑量 ATG 或許有可能成為高危險群的預防措施,與其它多種「單株抗體」,如:Teplizumab、Rituximab、Golimumab、Abatacept 所嘗試的雷同,這類治療一時之間都不會立即成為破解大魔王的神兵利器。
2. 基於自體抗原(如:自身胰島素)的口服耐受性免疫療法,在動物實驗中證實能恢復對自體抗原的免疫耐受,並且之後達到預防、延遲或逆轉 I-糖的作用。但人類的免疫機制較一般動物要複雜的多,且動物實驗常常偏重療效而忽略其安全性的相關研究,相同的治療方式(包括口服或鼻腔內給予)在人體內是否可行仍待更嚴謹的評估(Chin Med J. 2021 Jan 5;134(1):44–46.)。其它能誘發自體抗體的多種抗原(如:谷氨酸脫羧酶 (GAD-Alum)、或谷氨酸脫羧酶+維生素 D3),在安全性無慮下的人體實驗也在進行中。
新分期的臨床意義:
更新於 2023 年 07 月 01 日
I-糖從無臨床症狀到臨床確診是一種隨著時間推移的連續性病程。至今仍未有準確預測可能罹病的方法,但已知體內的自體免疫抗體越多,則罹患 I-糖的風險越高;而且越早產生 I-糖相關抗體,患 I-糖的風險就越大,如:9 個月大時具有兩種抗體的個體在兩年內罹患 I-糖的風險為 50%;然而,5 歲時產生兩種抗體者,兩年內罹患這種疾病的風險不到 10%。同樣,疾病發生的時間越早,發生 I-糖相關併發症的風險也越高。
不論兒童或成人,越早識別出可能病患,就能幫助其保留越多 β-細胞功能。通過針對 I-糖自體免疫抗體的篩查,新的分類法期待能《識別》及《量化》發生症狀性 I-糖的風險,還可以將疾病劃分為明確的階段,並且可以相當準確地預測及預防有症狀疾病的進展。
新分期依據臨床症狀、血糖值、糖尿病的實驗室標記及糖尿病的病理標記(自體免疫抗體)來分類,分述如下:
I-糖有關的自體免疫抗體:
對應不同的抗原,胰小島細胞自體抗體(Islet cell autoantibodies;ICA)的產生包括:
1. 谷氨酸脫羧酶 65 自體抗體(Glutamic acid decarboxylase 65 autoantibody;GAD65A)
2. 胰島素瘤抗原 2 自體抗體(Insulinoma antigen 2 autoantibody;IA-2A)
3. 鋅轉運蛋白 8 自體抗體(Zinc transporter 8 autoantibody;ZnT8-A)
4. 胰島素自體抗體(Insulin autoantibody;IAA) - 成人較少出現,不推薦,且外來胰島素治療超過 2 星期者也不適用
5. 胰小島細胞質抗體(islet-cell cytoplasmic autoantibody;ICA)- β-細胞只是胰小島的一種細胞而已。在極少的病例中,ICA 在其它抗體陰性時仍可檢測到
註一:大多數病患體內具有多種抗體。同時出現此前四種自體抗體,則新罹病 I-糖及「潛伏性成人自體免疫糖尿病(Latent autoimmune diabetes in adults;LADA)的檢出率高達 98%;猛爆型 I-糖(fulminant T1D)的自體抗體則為陰性。
註二:GADA 的專一性較差,在其它自體免疫疾病亦會出現,年長發病者出現的成份較高,所以對於成人 T1D 及 LADA的敏感性較高。而 IAA、IA-2A 及 ZnT8-A 在年輕發病者出現的成份較高。
註三:針對 I-糖病患的後代或其兄、弟、姐、妹在 5 年內罹病的高危篩查,不分年齡層,性價比最高的自體免疫抗體篩檢或許是 IA-2A 和 ZnT8-A。這兩種抗體是胰臟的 β-細胞明顯遭受破壞較後期(確診前期)的代理「生物標記物(biomarkers)」。
註四:隨著病程延長,自體抗體的陽性率逐漸降低;年齡越小的患者,陽性率越高。過去的診斷依據只專注自體抗體的陽性率,但已有研究顯示,抗體的濃度、親和力及類別也是關鍵的因素,如:I-糖者 GADA 和 IA-2A 兩項均會出現雙峰分佈(bimodal distribution)的濃度型態,而 LADA 者只有 GADA 單項出現雙峰分佈型態;年紀較輕者,IA-2A 的濃度較高,年紀越大者,GADA 的濃度較高。諸如此類新型的研究方向,其臨床意含或應用均有待進一步確認。
I-糖新分期及臨床意義:
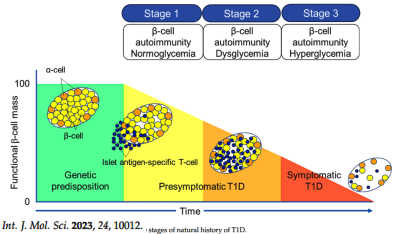
上圖:I-糖自然史的三個分期,由左向右:有基因傾向者,其胰小島自無法區分的正常狀態,隨著時間經過,胰小島內的 β-細胞漸漸地、及至嚴重地遭受破壞,其病理機制是程式化的 β-細胞凋亡(apoptosis)
第一期:有自體免疫抗體 +/血糖正常/症狀前。出現兩種或兩種以上胰島自身抗體,但血糖正常。在出生時進行遺傳風險篩查並達到此階段的兒童,5 年和 10 年內出現症狀性疾病的風險分別約為 44% 和 70%,終生風險接近 100%。
第二期:有自體免疫抗體 +/血糖異常/症狀前。具有兩種或多種胰島自身抗體,但發展為葡萄糖不耐症或血糖異常。此階段出現症狀性疾病在 2 年及 5 年內的風險分別約為 50% 和 75%,終生風險接近 100%。
第三期:有自體免疫抗體 +/血糖異常/已有症狀。典型臨床症狀和體徵,包括:多尿、煩渴、體重減輕、疲勞、糖尿病酮症酸中毒(DKA)等。隨著時間經過,自體免疫抗體也可能漸漸消失。
I-糖的緩解療法(Disease Modifying Therapies;DMTs)其主要目標是讓病人保留最多的 β-細胞功能,了解 β-細胞的功能轉變或弱化的時點成為介入性治療的最重要依據。新的分類法除了提供了該有的相關的資訊外,同時也能促進更多的《臨床試驗的設計》和《治療方法的開發》,以預防及治療症狀性疾病。
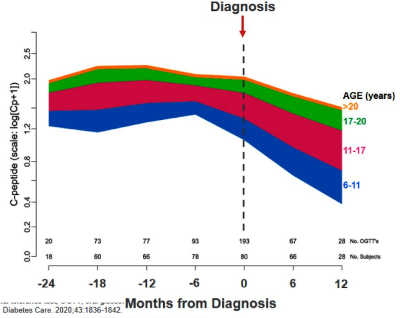
上圖:根據相稱的混合模型(其中以年齡作為連續變量),診斷 I-糖前後 C-胜肽平均下降率(虛線為確診點,不同顏色代表不同年齡層,橫軸的單位為月)。
由於第二期約在 6 個月後會轉進為第三期的風險相當高。研究顯示:在進展至第三期疾病的自體抗體陽性個體中,無論進展時間是否較短或 >5 年,C-胜肽對「口服葡萄糖耐受性試驗(Oral Glucose Tolerance Test,OGTT)」與「雜粕耐受性試驗(Mixed Meal Tolerance Test;MMTT)」的反應均呈現穩定但受損的模式,兩者之間也沒有太大區別。進一步分析顯示:雖然年齡會影響 C-胜肽下降的數量和速率,但所有年齡層在整個診斷期間內 C-胜肽的變化均具有相同的模式,其特徵為臨床診斷 6 個月前,C-胜肽沒有顯著地變化,確診前、後 6 個月內為重要的窗口期(如上圖),在此期間 β 細胞的功能經歷了快速下跌的變化。學者估計,在確診當下,大部分人殘留的胰小島仍有高達 ≧ 50% 的能力,這比以前的認知要高許多。保留越多的胰島素生成細胞,不僅讓日後的血糖管理更容易,且急慢性的併發症也會較少發生,因而能進一步改善生活品質,基於這些理由,確診前 6~12 個月會是一個有效介入性治療的重要窗口。(Diabetes Care 2020;43:1836–1842)
I-糖病患的一等及二等親屬罹患相同疾病的風險分別是普通人群的 15 倍及 2 倍,是高危篩查及早期介入性預防治療的主要對象,希望能在第一期或第二期時就阻止該疾病的進程。目前篩查的策略根據年齡而定,如下:
1. 不分年齡,均檢查 GADA
2. 如 GADA 陰性:A) 年齡小於 10 歲者:加查 IAA 和 ZnT8-A;B) 年齡大於 10 歲者:加查 IA-2A 和 ZnT8-A;C) 成人:加查 IA-2A、ZnT8-A 和/或 ICA
已知的臨床運用:
之前,已有研究顯示 teplizumab 可以延長最近診斷為 I-糖的受試者的胰島素分泌時間。新近,一項針對這些高危親屬(參與者中 >70% 的年齡 <18 歲)的研究中發現,與接受安慰劑的受試者相比,在隨機接受為期 14 天 teplizumab 治療者,研究期間將被診斷為 I-糖的風險降低了 59%。接受 teplizumab 治療者在接受治療後平均 48.4 個月才出現 I-糖,而服用安慰劑者在開始研究後 24.4 個月就被診斷出患有 I-糖,該藥物本質上使受試者平均多了兩年無糖尿病。(N Engl J Med 2019; 381:603-613)
截至目前為止,Teplizumab(anti-CD3 monoclonal antibody)的免疫治療(immunotherapy)已經獲得美國 FDA 批准,僅適合於 ≧ 8 歲的第二期病患,用於保留更多 β-細胞的功能併遲滯第三期的發生,但兩週療程的費用接近 20 萬美元。其餘,如:Rituximab、Golimumab、Abatacept、Etanercept 及 Alefacept 雖可保留更多 β-細胞的功能,但無助於延遲第一期 I-糖病患的進一步發展。而抗胸腺細胞球蛋白(anti-thymocyte globulin:ATG)的治療仍在 TrialNet 第二期的實驗途中。這些介入性治療還需要考慮的是其副作用,常見者如:頭痛、皮疹及淋巴球細胞減少症等等。
硫氧還蛋白-相互作用蛋白(thioredoxin-interacting protein;TXNIP)是胰腺 β-細胞功能異常和死亡的關鍵因素之一,是人類胰島細胞暴露於高水平葡萄糖時上調最多的基因。當 TXNIP 過度表時達會誘導 β-細胞凋亡,並參與糖毒性誘導的 β-細胞死亡,而阻斷 L-型鈣通道不僅能引發細胞內遊離鈣減少,同時也能抑製細胞內 TXNIP 的轉錄,降低其表現,從而有利於保存胰島 β-細胞。依據這種可能性,針對兒童及青少年、體重 ≧ 30 公斤、新診斷為 I-糖(第三期)的小型 RCT 實驗:每日一次口服《 L-型鈣離子阻斷劑 verapamil》組,在診斷後 52 週時仍部分保留了雜粕耐受性試驗刺激後的 C-胜肽分泌,這是 β-細胞功能的衡量指標(JAMA. 2023 Mar 28;329(12):990-999)。
